O Prêmio Nobel se abrange a várias áreas, desde literatura, à física, matemática, medicina, até química. O químico holandês, Jacobus Henricus van’t Hoff (1852 – 1911), por seus trabalhos com dinâmica química e a descoberta da pressão osmótica em soluções, foi laureado com o primeiro Prêmio Nobel de Química da história, que futuramente passou por mãos mundialmente famosas como as de Svante Arrhenius (1859 – 1927), Adolf Von Baeyer (1835 – 1917), Victor Grinard (1871 – 1935) , Marie Curie (1867 – 1934) e tantos outros.

As contribuições de van´t Hoff se estendem a várias áreas, desde a estereoquímica até a físico-química. Esta última que inclusive deu ao holandês a sua fama em todo o ramo científico, tendo inclusive uma equação que leva o seu nome. Jacobus foi fundamental para o desenvolvimento de inúmeros aspectos para a físico-química moderna.
1) Propriedades coligativas
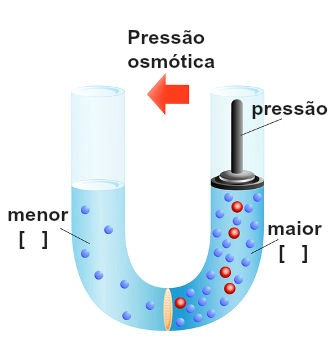
Um dos aspectos que garantiu a van’t Hoff o Nobel de Química foi a descoberta da pressão osmótica, a base da Osmoscopia, uma das propriedades coligativas. Esta enuncia que o aumento da quantidade de partículas em solução resulta no aumento da pressão osmótica, sendo esta a pressão que deve ser exercida sobre um sistema para evitar que o processo osmótico ocorra. Podemos calcular a pressão osmótica de uma solução da seguinte maneira:

Ainda neste assunto, podemos destacar o Fator de Correção de van’t Hoff, que mede o efeito coligativo de cada solução através da quantidade de partículas na mesma. Esse fator está presente em todos os cálculos de efeito coligativo, e pode ser calculado por meio de:

2) Cinética Química

Seus trabalhos em cinética química também constam em seu prêmio. Mesmo esse assunto tendo sido extensamente abordado por Maximilian Guldberg (1836-1902) e Peter Waage (1833-1900), os quais levaram muitos créditos pela elaboração da Lei de Ação das Massas, Jacobus também teve um papel fundamental.
Podemos destacar aqui a Regra de van’t Hoff. Como sabemos, ao aumentar a temperatura de um sistema reacional, por conta do aumento da energia cinética dos reagentes, o número de colisões efetivas também o faz e, consequentemente, a velocidade da reação é aumentada. Experimentalmente, o químico holandês descobriu que para cada aumento de 10°C na temperatura, a velocidade da reação é duplicada. Atualmente sabemos que essa regra apresenta várias exceções, mas é muito útil para previsões aproximadas em determinadas reações.
3) Equilíbrio Químico e Termodinâmica
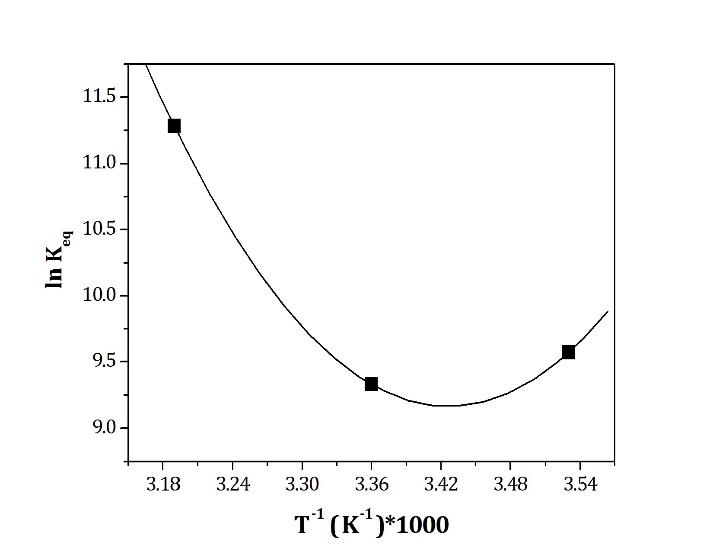
Van’t Hoff também teve um papel único e primordial no que une essas duas áreas da físico-química, o equilíbrio químico e a termodinâmica, ao elaborar a Equação que leva seu nome. A Equação de van’t Hoff relaciona a mudança no valor da constante de equilíbrio em uma reação ao se variar a temperatura da mesma, em função da variação de entalpia da reação, ou anida em função da variação de entropia do sistema. Temos assim que:


Para ter um conteúdo de ponta e preparação mais aprofundada de química para o Enem e outros vestibulares, assine o Química Premium! Essencial para você que quer ver a química de uma maneira mais aprofundada!







