O Equilíbrio Químico ocorre em uma reação reversível, quando a velocidade da reação direta é igual a velocidade da reação inversa. Quando o estado de equilíbrio é alcançado, as concentrações de reagentes e produtos permanecem constantes. Observe o exemplo:
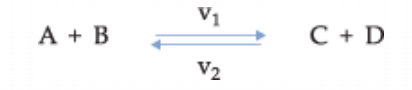
Inicialmente, v1 é máximo, pois as concentrações A e B apresentam valor máximos, já v2 é igual a zero, uma vez que C e D ainda não foram formados. Conforme a reação vai começando, os valores de A e B diminuem, enquanto C e D aumentam, ou seja, v1 diminui e v2 aumenta. Quando v1 e v2 se igualam, é chegado ao estado de equilíbrio.
Quando o equilíbrio ocorre, a reação química continua ocorrendo nos dois sentidos e com a mesma velocidade, fazendo com que as concentrações de reagentes e produtos fiquem constantes. Logo, temos o que chamamos de equilíbrio dinâmico. Se olharmos o sistema como um todo, a reação parou de acontecer, pois as concentrações de reagentes e produtos não sofrem alteração indefinidamente.
Lembre-se que para atingir um estado de equilíbrio é necessário que:
– o sistema esteja em ambiente fechado;
– a temperatura fique constante.
 Quer entender melhor e saber ainda mais? o QG irá realizar uma aula do curso Foca na Medicina aberta para não alunos assistirem. O professor de Química, Silvio Predis, irá se aprofundar no tema Equilíbrio Químico passando por conceitos, constantes e Le Chatelier. Para receber um lembrete antes da aula, clique aqui.
Quer entender melhor e saber ainda mais? o QG irá realizar uma aula do curso Foca na Medicina aberta para não alunos assistirem. O professor de Química, Silvio Predis, irá se aprofundar no tema Equilíbrio Químico passando por conceitos, constantes e Le Chatelier. Para receber um lembrete antes da aula, clique aqui.






