Muita coisa acontece dentro de uma pilha ou bateria quando você liga uma lanterna, muda de canal com o controle remoto da sua TV ou usa qualquer tipo de eletrônico. Existe um processo complexo dentro da pilha que faz com que ela funcione e, hoje, vamos te explicar passo a passo como este processo ocorre. Veja:
O que é uma pilha?
Toda pilha é um dispositivo que possui dois eletrodos e um eletrólito em que ocorrem reações espontâneas de oxirredução capazes de gerar uma corrente elétrica.
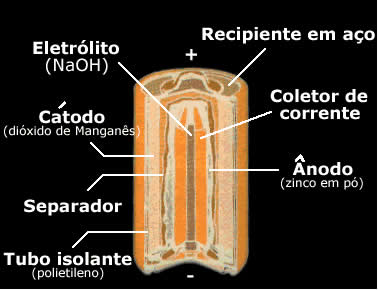
O eletrodo positivo de uma pilha é chamado de cátodo e é onde ocorre a reação de redução. Já o eletrodo negativo é chamado de ânodo, e é onde ocorre a reação de oxidação. O eletrólito, ou também chamado de ponte salina, é a solução condutora de íons que formam a corrente elétrica gerada pela pilha.
Recapitulando:
Ânodo ou polo negativo é o eletrodo onde saem os elétrons. Ocorre a reação de oxidação.
Cátodo ou polo positivo é o eletrodo para onde vão os elétrons. Ocorre a reação de redução.
No caso da pilha alcalina, aquelas que estamos acostumados a usar no dia a dia, tem-se uma barra de manganês metálico eletroliticamente puro, imerso em uma pasta de hidróxido de zinco, e responsável por conduzir a corrente elétrica.
Pilha de Daniell
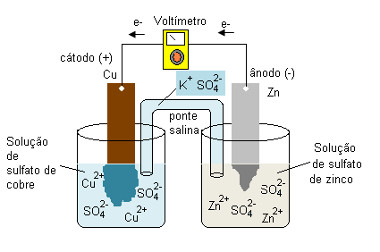
Uma das primeiras pilhas criadas, e também bastante cobrada no Enem e nos demais vestibulares, é a famosa Pilha de Daniell. O meteorologista e químico inglês, John Frederic, Daniell constitui, através de uma experiência, uma pilha formada a partir de reações de oxirredução.
Daniell montou um sistema com dois eletrodos conectados, um com carga positiva e outro com carga negativa. Um eletrodo era constituído por uma placa de Zinco imersa em uma solução com íons de Zinco (Sulfato de Zinco). O outro eletrodo era constituído por uma placa de cobre imersa em uma solução com íons de cobre (Sulfato de cobre).
Neste caso, o eletrodo de Zinco era o ânodo da pilha, por possuir carga negativa. Já o eletrodo de cobre, era o cátodo, por constituir carga positiva.
Veja a imagem:
As duas soluções foram ligadas por uma ponte salina, que era uma um tubo de vidro com uma solução de sulfato de potássio e com lã de vidro nas extremidades, através de um circuito externo.
O que Daniell observou foi que o Zinco tem maior tendência a se oxidar, ou seja, perder elétrons, e por isso funciona como um eletrodo negativo (ânodo). Os elétrons perdidos pelo Zinco são transportados pelo circuito externo até a placa de Cobre (catodo), gerando a corrente elétrica que seria capaz de acender uma lâmpada, por exemplo. No outro eletrodo, os elétrons da solução de sulfato de cobre se depositam na placa de cobre, diminuindo a concentração da solução e aumentando a massa da placa metálica.
Agora veja como esse funcionamento é representado em equações:
Semirreação no ânodo: Zn( s) ↔ Zn2+(aq) + 2 e–
Semirreação no cátodo: Cu2+(aq) + 2 e– ↔ Cu( s)
Equação Global: Zn(s) + Cu(aq)+2 → Zn(aq)+2 + Cu
Como este assunto pode ser cobrado no Enem e vestibulares ?
Gabarito: B
 Aproveita para conhecer o curso Foca na Medicina, é só clicar aqui.
Aproveita para conhecer o curso Foca na Medicina, é só clicar aqui.