Toda reação Química, a princípio, pode ser considerada reversível. Ou seja, podem ocorrer no sentido reagentes → produtos, e também no sentido produtos → reagentes. O Equilíbrio Químico em uma reação ocorre quando a proporção entre as quantidades de produtos e reagentes se mantém constante ao longo do tempo, ou seja, com a mesma velocidade.
Condições para que ocorra o Equilíbrio Químico:
- Velocidade da reação direta igual a velocidade da reação inversa
- A reação deve ser uma reação reversível
- Concentração ou pressões (para gases) constantes
- A reação deve ocorrer em um sistema fechado
Para entender melhor como funciona o Equilíbrio Químico, observe como funciona a reação (reversível) da produção da amônia (NH3), a partir do gás hidrogênio (H2) e do gás nitrogênio (N2):
![]()
.png) Agora observe graficamente como ocorre a reação de equilíbrio. É possível perceber que inicialmente há somente os gases N2 e H2, e nenhuma NH3 formada. Na medida com que o gás de amônia vai se formando, ocorre também a reação indireta, ou seja, o decaimento dos gases de hidrogênio e nitrogênio. Em certo momento, a concentração das duas reações passam a ser constantes, ocorrendo então o Equilíbrio Químico.
Agora observe graficamente como ocorre a reação de equilíbrio. É possível perceber que inicialmente há somente os gases N2 e H2, e nenhuma NH3 formada. Na medida com que o gás de amônia vai se formando, ocorre também a reação indireta, ou seja, o decaimento dos gases de hidrogênio e nitrogênio. Em certo momento, a concentração das duas reações passam a ser constantes, ocorrendo então o Equilíbrio Químico.
Fatores que influenciam no Equilíbrio Químico:
Concentração: Em um sistema de equilíbrio, o aumento da concentração de qualquer elemento favorece a reação que consome, assim como a diminuição deste elemento também irá favorecer a reação que forma este componente.
Pressão: A variação da pressão só deslocará equilíbrios que contenham elementos gasosos, pois os gases podem apresentar variação de volume em função da pressão exercida.
Temperatura: De acordo com o princípio de Le Chatelier (veja aqui as principais leis da Química), em um sistema de equilíbrio que tenha pressão constante, o aumento do temperatura poderá propiciar o deslocamento do equilíbrio na direção da reação que absorve calor, assim como a diminuição ocasionará o deslocamento na reação que libera calor.
Efeito do catalisador: Os catalisadores são substâncias adicionadas a uma reação que possuem o objetivo de aumentar a sua velocidade. Os catalisadores, por modificarem os mecanismos das reações, também têm a capacidade de diminuir a energia necessária para que uma reação ocorra (energia de ativação). Por isso, os catalisadores influenciam no tempo que uma reação leva para entrar em Equilíbrio Químico, mesmo sem deslocar estes equilíbrios.
Entendendo o que é a Constante de Equilíbrio:
A constante de equilíbrio é um valor que relaciona as concentrações dos elementos reagentes e do produto no momento em que o equilíbrio químico ocorre em uma reação. A constante de equilíbrio é representada pela letra Kc, em função da concentração dos elementos em mol L -1 ou [ ] mol L-1. No caso de substâncias gasosas, a constante de equilíbrio é representada por Kp, em função das pressões parciais presentes no equilíbrio.
Veja abaixo uma reação genérica:
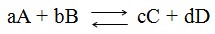

 Tá querendo saber mais sobre Equilíbrio Químico, Funções Orgânicas (saiba mais) e muito mais para arrasar no Enem? Não deixe de assistir o nosso Prof. Roberto Mazzei de Química fazendo uma super participação no programa Hora do Enem da TV Escola!
Tá querendo saber mais sobre Equilíbrio Químico, Funções Orgânicas (saiba mais) e muito mais para arrasar no Enem? Não deixe de assistir o nosso Prof. Roberto Mazzei de Química fazendo uma super participação no programa Hora do Enem da TV Escola!
Será no dia 18 de agosto (quarta), nos seguintes horários: 7h, 13h ou 18h.
Não sabe qual é o canal da TV Escola na sua cidade? Veja aqui:http://bit.ly/TVEscolaCh








